Спектрофотометрия в биохимических исследованиях | Статья
Спектрофотометр измеряет пропускание света, т.е. снижение интенсивности падающего света I0 до интенсивности I при прохождении через кювету с раствором. Изменение интенсивности света связано с концентрацией анализируемого вещества в растворе законом Бугера-Ламберта-Бера:
I/I0 = e-εcd (1)
где d – длина оптического пути, ε – коэффициент поглощения, которая является константой для анализируемого вещества, с — концентрация анализируемого вещества. Интенсивность падающего света I0 определяется как общая интенсивность света и принимается за 100%. Экспоненциальная зависимость может быть преобразована в линейную форму, где отрицательный логарифм пропускания заменен на поглощение А:
A = - log(I/I0) = εcd
Область применения спектрофотометрических методов в химической или биохимической лаборатории довольно широка. На определении оптического поглощения основаны различные методы количественного анализа аминокислот, белков, коферментов, НАДФ, нуклеиновых кислот, липидов, углеводов и др. соединений. Большая часть методов ферментативного анализа также связано с измерением оптического поглощения. Кроме того, спектрофотометрия может быть использована для установления зависимости между спектрами поглощения различных соединений и их химическим строением, т.е. проведения не только количественного, но и качественного анализа. С помощью спектрофотометрии можно также проводить турбидиметрический анализ, т.е. проводить измерение света, прошедшего через суспензии, эмульсии и коллоидные растворы. В этом случае свет не поглощается, а преимущественно рассеивается, тем не менее уменьшение интенсивности света может быть определено на обычном спектрофотометре. Поэтому спектрофотометрия может быть также использована при анализе клеточных культур, жировых эмульсий, мицелл и других полимерных структур.
В спектрофотометрии выделяют две основные группы методов: абсорбционные методы, в которых количество вещества определяется из его собственного поглощения, и колориметрические методы, в которых используются дополнительны окрашивающие соединения, а интенсивность окраски анализируемого образца оценивают по калибровочной кривой для соответствующего красителя. Для осуществления всех этих методов могут быть использованы одни и те же инструменты.
Количественное определение белков
Измерение концентрации белка в жидких пробах является обычной процедурой во многих научных лабораториях. Точная количественная оценка имеет большое значение для всех экспериментов, связанных с белками во множестве научно-исследовательских тем в области биохимии, молекулярной биологии, клеточной биологии, биологии развития и генетике. Существуют различные методы для количественного определения белка, многие из которых основаны на измерении спектра поглощения белков или белковых комплексов при определённых значениях длин волн.
С помощью спектрофотометрических методов может быть проведено прямое определение белка путём измерения оптического поглощения при 280 нм, основанное на присутствии в составе белка остатков ароматических аминокислот тирозина и триптофана. Этот способ прост и требует очень небольшого объема образца. Кроме того, после измерения образец можно использовать вновь. В то же время чувствительность метода невысокая, измерению мешает присутствие любых веществ, поглощающих в ультрафиолетовом диапазоне, в первую очередь остатков нуклеиновых кислот, чей пик поглощения на длине волны 260 нм в значительной степени перекрывает пик белков при 280 нм.
Для количественного и качественного определения белка используют также различные цветные реакции, основанные на взаимодействии определенных аминокислотных остатков с окрашивающими соединениями. К наиболее распространённым методам количественного определения белка относятся анализ на основе бицинхониновой кислоты, анализ методом Брэрдфорда и анализ методом Лоури.
Метод на основе бицинхониновой кислоты использует реакции окислениия ионов меди Cu2+ до Cu+ в щелочной среде под действием аминокислот и образование окрашенного комплекса между ионами Cu+ и бицинхониновой кислотой, имеющего пик поглощения при длине волны 562 нм.
Аналитический метод Брэдфорда является одним из самых распространенных методов определения концентрации белка. Метод основан на образовании комплекса между красителем Кумасси бриллиантовым синим G-250 и белками в растворе. Кумасси связывается с главным образом с аргинином, триптофаном, тирозином, гистидином, фенилаланином. Образующиеся комплексы имеют оптическую плотность при 590—595 нм.
Метод Лоури также основан на окислении ионов меди Cu2+ до Cu+ в щелочной среде под действием аминокислот. Далее происходит реакция между ионами меди Cu+ и реактивом Фолина с образованием молибденовой сини, имеющей максимум адсорбции при 500—800 нм.
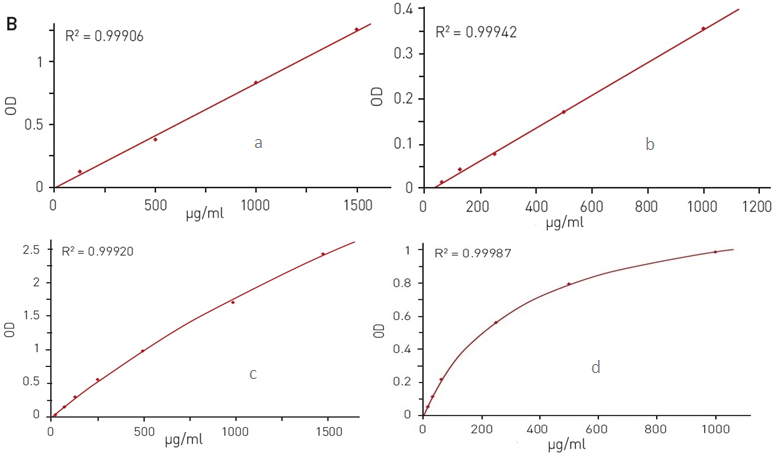
Количественное определение белка: А) путём измерения абсорбции на длине волны 280 нм; Б) методом Брэдфорда; В) методом на основе бицинхониновой кислоты; Г) методом Лоури.
Эксперименты по количественному определению белка могут выполняться в кюветах, а также в микропланшетных ридерах, которые позволяют обрабатывать большое количество образцов за один промежуток времени. Недавно появилась статья, посвящённая применению многорежимных планшетных ридеров BMG Labtech для определения количества белка различными методами. Исследователями было проведено испытание приборов SPECTROstar Nano, FLUOstar Omega, PHERAstar FSX и CLARIOstar. Было проведено четыре эксперимента, основанных на описанных выше методах количественного определения белка. Для детекции использовался широко применяемый в лабораторной практике бычий сывороточный альбумин.
Концентрация белка (мкг/мл) | 15,63 | 31,25 | 62,5 | 125 | 1000 | 1500 | Время (мин) | Объём образца (мкл) | Длина волны (нм) | Минимальное количество белка (мкл) |
A280
| - | - | - | ● | ● | - | 1 | 2—3 | 280 | 0,38 |
Брэдфорд
| - | - | ● | ● | ● | - | 5 | 5 | 595 | 0,31 |
БХК
| ● | ● | ● | ● | ● | ● | 30 | 30 | 562 | 0,47 |
Лоури
| ● | ● | ● | ● | ● | - | 50 | 100 | 710 | 1,56 |
Несмотря на то, что методы количественного определения белка различались в отношении охватываемого диапазона концентраций, требуемого объема и времени подготовки и инкубации, во всех случаях приборы BMG LabTech продемонстрировали высокую чувствительность и воспроизводимость результатов.
Ферментативный анализ
Протекание различных химических реакций в биологических системах (в т.ч. ферментативных) сопровождается изменением количественного состава среды, что может быть детектировано с помощью спектрофотометрии. Т.о. метод позволяет исследовать ферментативную активность, а также экспрессию генов, кодирующих ферменты.
Так, в одной из статей было продемонстрировано применение спектрофотометра V-650 (Jasco, Япония) для определения параметров ферментативной реакции (константа Михаэлиса-Ментен, максимальная скорость) на примере щелочной фосфатазы. В эксперименте был использован п-нитрофенилфосфат. Под действием щелочной фосфатазы бесцветный п-нитрофенилфосфат расщепляется на окрашенный п-нитрофенол и ортофосфорную кислоту.
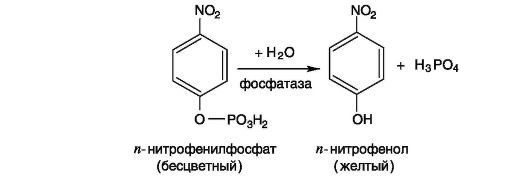
Определение параметров ферментативной реакции осуществляется в несколько этапов.
Анализ спектра поглощения п-нитрофенола позволяет установить длину волны, соответствующую пику поглощения для данного соединения, чтобы затем проводить измерение интенсивности света именно на этой длине волны.
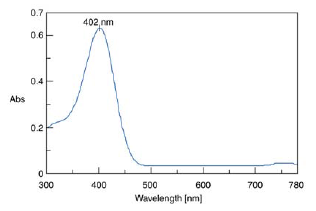
Спектр оптического поглощения для п-нитрофенола показывает, что данное вещество имеет пик на длине волны 402 нм.
Параметры ферментативной реакции связаны между собой уравнением Михаэлиса-Ментен:
v = vmS/(S+KM)
где v – это скорость протекания ферментативной реакции, vm – максимальная скорость протекания реакции, S – константа субстрата, KM – константа Михаэлиса, по определению KM = (k-1 + k2)/k1, где k1 – это константа скорости реакции образования фермент-субстратного комплекса из фермента и субстрата, k-1 – константа скорости обратной реакции, т.е. диссоциации фермент-субстратного комплекса на фермент и субстрат, k2 – константа скорости превращения фермент-субстратного комплекса в фермент и продукт реакции. Чтобы определить KM и vm, проводят серию измерений, необходимо измерение скорости реакции при различных концентрациях субстрата.
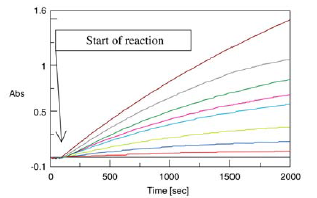
Изменение оптического поглощения для растворов с разными концентрациями субстрата (п-нитрофенола).
Обычно всю необходимую информацию можно извлечь из графика зависимости v от S, однако иногда удобнее привести уравнение Михаэлиса-Ментен к линейной форме.
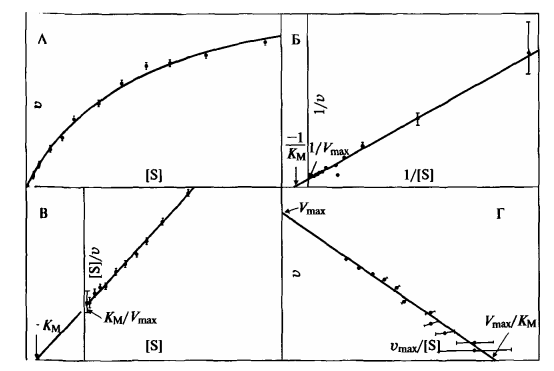
Варианты представления полной кинетической кривой, описываемой уравнением Михаэлиса-Ментен: А — полная кинетическая кривая, Б — координаты Лайнуивера-Берка, В — координаты Хайнса, Г — координаты Иди-Хофсти.
Аналогичным образом спектрофотометрическое оборудование может быть использовано для определения диапазона действия ферментов (температура, pH), изучения более сложных механизмов, например, механизмов ингибирования, многосубстратных реакций, влияния адсорбции ПАВ на ферментативную активность и осуществления других измерений.
Спектрофотометрический качественный анализ
Спектрофотометрические методы могут быть использованы не только для определения количества вещества в анализируемом образце, но и сама природа вещества. Качественный спектрофотометрический анализ основан на том, что каждое химическое соединение имеет характерный для данного вещества спектр поглощения. Положение и интенсивность пиков поглощения определяются входящими в состав вещ

