Клеточные исследования методом флуоресценции.
С момента выделения белка, флуоресцирующего в зеленой области спектра (БФЗ), из медузы Aequorea Victoria в 1960 году и его синтеза в начале 1990-х, биохимики разработали сотни флуоресцирующих белков и красителей для биологических, биохимических и биомедицинских приложений.
В настоящее время флуоресценция является, наиболее широко используемым методом измерения при проведении биологических исследований. Тысячи различных тестов, специально разработанных для изучения различных клеточных процессов, могут быть проведены с помощью флуоресцентных белков. Внутриклеточный транспорт, передача сигналов, потеря чувствительности рецепторов, движение клеток, миграция, деление, апоптоз, метаболизм, дифференциация и хемотаксис - всего лишь несколько примеров таких приложений.
Одновременно с разработкой новых флюорофоров, совершенствовались и приборы, способные измерять флуоресценцию для аналитических целей. Микроскопы, проточные цитометры (ПЦ) и микропланшетные ридеры являются основными типами инструментов, применяемых для измерения флуоресценции при проведении клеточных исследований.
Микроскоп отображает снимки (и видео) клеточных процессов в режиме реального времени, используя различные флуоресцентные белки с разрешением в микроны. Микроскопы позволили исследователям получить замечательные снимки биологических процессов с использованием флуоресцентных белков. Однако, микроскопия требует значительных затрат времени, необходимого для накопления воспроизводимых и надежных данных, поскольку только одна клетка или клеточной кластер могут быть проанализированы в один момент. Кроме того, микроскопические исследования обеспечивают в основном качественный анализ, количественные параметры могут быть определены лишь частично.
Еще одним важным инструментом, который применяется в биолабораториях, стал проточный цитометр. Специализированные цитометры позволяют сортировать клетки с применением флуоресценции (СКПФ). Эти приборы часто используются для проведения высокопроизводительного скрининга (ВПС) и скрининга отдельных клеток - целломики (cellomics). Цитометр предоставляет возможность разделения смешанной популяции клеток на однородные подгруппы с последующим подсчетом клеток с наличием или отсутствием различных флуоресцентных меток. По сравнению с микроскопией, СКПФ цитометры обеспечивают высокую пропускную способность, проводя автоматизированный подсчет количества конкретных клеточных популяций. Однако, как и при микроскопических исследованиях, метод потоковой цитометрии ограничен временем, которое требуется, чтобы получить данные о различных активирующих соединениях в различных концентрациях. В зависимости от качества и количества образцов, СКПФ эксперименты может занять несколько часов. Долгие анализы, в свою очередь, влияют на полученные результаты. За длительное время клетки могут снизить или прекратить исследуемую клеточную активность, а ответная реакция на стресс может повлиять на точность считывания данных.
Микропланшетные ридеры и клеточные исследования на основе флуоресцентных белков.
В настоящее время микропланшетные флуориметры доступны большинству биологических и биохимических лабораторий. Сначала они чаще всего использовались в био- (научных и производственных) скрининговых лабораториях для простых (гомогенных) флуоресцентных экспериментов. Сейчас микропланшетные ридеры превратились в многофункциональные инструменты, которые могут выполнять сложные гетерогенные клеточные исследования. Новые форматы микропланшет до 3456 лунок позволили значительно уменьшить объем образцов до нанолитров, увеличивая пропускную способность и снижая расходы. Наконец, микропланшетные ридеры позволяют проводить воспроизводимые клеточные анализы за секунды или минуты, в зависимости от плотности лунок микропланшета.
При проведении клеточных исследований в режиме реального времени наилучшие результаты могут быть достигнуты при считывании из нижней части микропланшет, а не с верхней. Нижнее считывание обеспечивает ряд преимуществ при измерении сигналов от клеток. Поскольку слой клеток прилипает ко дну лунки, приемник света может быть размещен ближе к образцу, уменьшая рассеивание. Кроме того, значительно снижается эффект от вмешательства в клеточную культуральную среду. Оба фактора повышают чувствительность. Также, нижнее считывание позволяет закрыть микропланшет крышкой или пленкой, предотвращающее загрязнение клеток и испарение жидкости. Это особенно важно при длительных экспериментах с повторяющимися измерениями, например, при изучении медленной кинетики.
Несмотря на перечисленные преимущества, считывание с верхней части микропланшет без крышки всегда даст более высокое соотношение полезный сигнал/холостая проба, чем измерение снизу. Основной причиной является пластик дна микропланшет, который отрицательно влияет на пропускание света, как возбуждения, так и эмиссии, что приводит к снижению интенсивности. Частично это явление можно преодолеть с помощью специальных микропланшет с дном из кварца или стекла. Отражение света от поверхности пластика также увеличивает сигнал от холостой пробы. Другим фактором является наличие волоконно-оптического световода, применяемого в большинстве микропланшетных ридеров для доступа к нижней части микропланшет, так как потери пропорциональны длине волоконной оптики. Все это приводит к потере сигнала при измерении флюорофора снизу микропланшет и снижает производительность прибора. Первые два недостатка зависит от химических и физических свойств пластика, из которых изготовлены микропланшеты, третий недостаток можно устранить с помощью улучшения конструкции ридера.
У ридеров PHERAstar® FS и CLARIOstar® прямой оптический путь к нижней части микропланшета.
Для повышения эффективности проведения клеточных анализов с помощью микропланшетных ридеров, немецкая компания BMG LABTECH отказалась от применения волоконной оптики в режимах верхнего и нижнего считывания. Оригинальная технология верхнего и нижнего считывания, разработанная фирмой, нашла применение в высокопроизводительном ридере PHERAstar и оснащенном монохроматорами ридере CLARIOstar, установив новый стандарт нижнего считывания для микропланшетных приборов. Так же, как в микроскопе, оптический путь PHERAstar FS и CLARIOstar проходит только через воздушное пространство внутри прибора и для фокусировки света в нижней или верхней области микропланшета световоды не требуются. Это реализуется с помощью системы зеркал, привод которых управляется программой. Оптическая система непосредственного считывания со дна лунок обеспечивает улучшение соотношения полезный сигнал/холостая проба по сравнению с ридерами на основе волоконной оптики (Рис.1).
Волоконно-оптический кабель состоит из пучка стеклянных волокон, проводящих свет. Каждое волокно обычно покрыто защитным слоем, который образует промежутки между волокнами в кабеле. По пучку передается свет, попадающий точно внутрь волокна, свет попадающий в промежутки между волокнами поглощается покрытием. Таким образом, существенная доля света (до 20%) не попадает в световод из-за этих промежутков, приводя к заметной потере. Дополнительными ограничениями, уменьшающими пропускание света, являются диаметр волокна и угол сбора светового потока. Все эти недостатки отсутствуют в конструкции с прямым оптическим путем. Зеркала обеспечивают почти полное отражение, позволяя пропускать до 97% света без ограничений по площади и углу сбора.
В ридерах CLARIOstar и PHERAstar, оснащенных оптической системой с прямым оптическим путем через воздушное пространство, устранена необходимость в оптоволоконных световодах. Переключение между режимами чтения сверху и снизу происходит с помощью простого щелчка мыши в управляющем программном обеспечении. Не требуется никаких механических манипуляций, например, установки или снятия дополнительного оборудования.
Дополнительные технические решения расширяют возможности нижнего считывания при проведении клеточных исследований. Обычно микропланшетные ридеры измеряют свет в центре лунки на высоте, оптимизированной для исследования жидких (однородных) образцов. Измерение эмиссии от прилипших клеток, как правило, требует различную высоту фокусировки, и сгустки клеток гетерогенно распределены по дну лунки. Поэтому способность сфокусироваться на клеточном слое и режим сканирования дна лунки существенно влияют на эффективность и чувствительность нижнего считывания для клеточных тестов. Система с прямым оптическим путем анализаторов CLARIOstar и PHERAstar может быть соединена с устройством автоматической фокусировки, которое точно сфокусирует свет на клеточном монослое в нижней части лунки с разрешением по высоте 0,1 мм и с возможностью сканирования дна лунки с разрешением 900 точек на лунку (Рис.2-3).
Примененные совместно, технологии могут существенно улучшить чувствительность и повысить эффективность флуоресцентных клеточных исследований. Для достижения наилучших результатов необходимо использовать планшеты с дном из прозрачного стекла или кварца и черными стенками и ридеры с оптическим путем, проходящим через атмосферу и автоматической регулировкой фокуса.
Рисунок 1. Сравнение соотношения полезный сигнал/холостая проба для режимов верхнего и нижнего считывания. Эндотелиальные клетки аорты быка с метками БФЗ измеряется на ридере с прямым оптическим путем (PHERAstar FS) и ридере с волоконной оптикой.
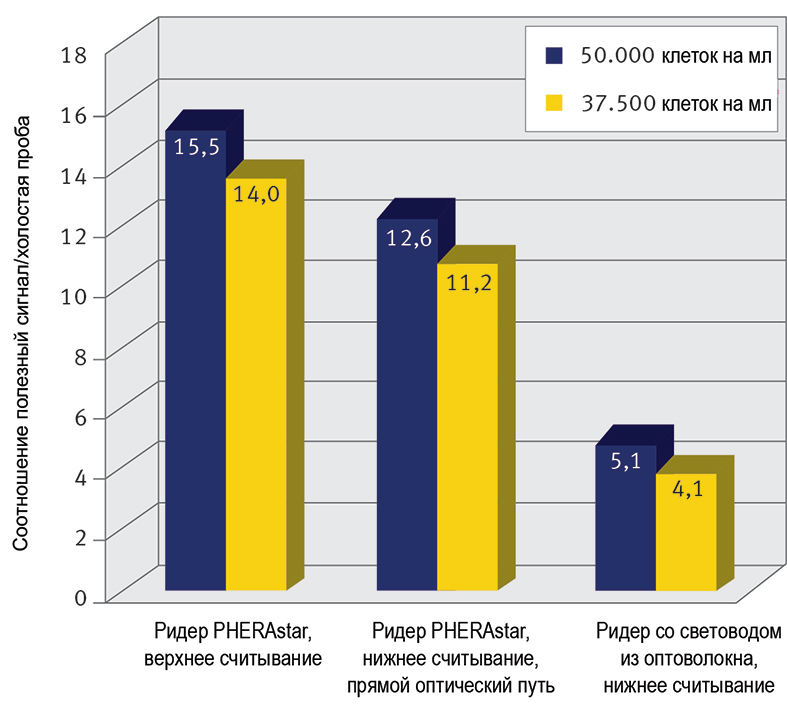
Рисунок 2. Сканирование слоя клеток в режиме нижнего считывания с разрешением 100 точек на лунку показывает неравномерность распределение клеток печени в каждой лунке. Отклик кальция в образцах с высокой плотностью клеток в середине лунки был намного сильнее, чем в образцах с низкой плотностью в середине при считывании из центра лунки.
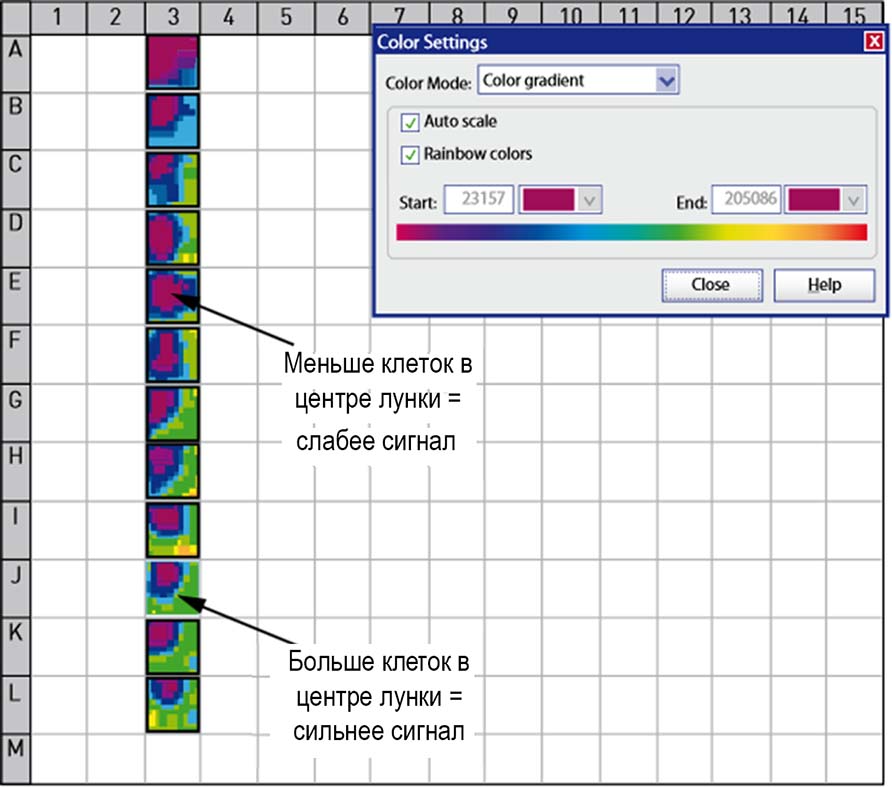
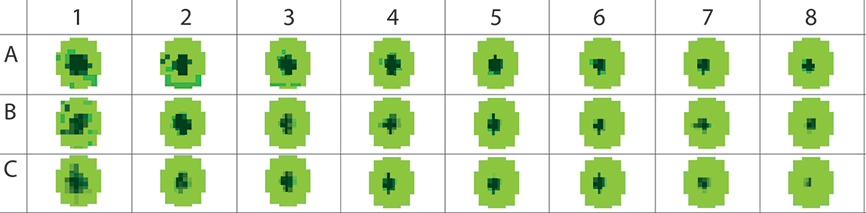
Рисунок 3. Безмембранный тест миграции клеток OrisTM выполнялся на раковых клетках U2OS на ридере BMGLABTECH с прямым оптическим путем в режиме сканирования лунок.